|
古細菌から高等動物まで、あらゆる生物に分布しているアミノ酸変換酵素(ラセマーゼ、アミノトランスフェラーゼ, etc, etc….)。やり尽くされた感もありますが、ちょっと変わったアミノ酸に注目して研究を進めています。具体的にはアスパラギン酸アナログの3-ヒドロキシアスパラギン酸、プロリンアナログのアゼチジン-2-カルボン酸などを変換する酵素を探索しています。古典的な土壌分離から初めて、新しい研究のネタを探します。
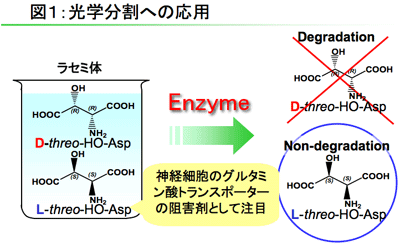
分子中に2つの不斉炭素を持つ3-ヒドロキシアスパラギン酸は哺乳類の神経細胞の興奮性グルタミン酸トランスポーターの競争的阻害剤として知られており、特にL-threo体が生理活性が強いことで知られています。D-threo体のみを分解する酵素が見つかれば、有機合成されたDL-threo混合物であるラセミ体からD-threo体のみを酵素を用いて分解しL-threo体を得るという酵素的光学分割法に応用できるかもしれません。(図1)
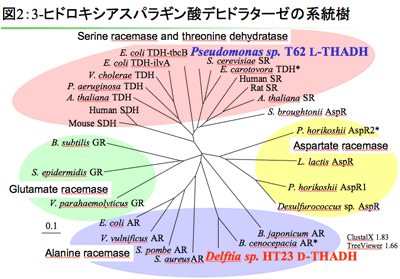
またこの研究の過程で2つの新規酵素、L-threo-3-ヒドロキシアスパラギン酸デヒドラターゼ(Pseudomonas sp.T62由来)とD-threo-3-ヒドロキシアスパラギン酸デヒドラターゼ(Delftia sp. HT23由来)を発見しました。これらの酵素は認識する基質の立体化学が異なるだけですが、1次構造上の相同性はなく(図2)酵素科学の基礎的な発見としても興味深いと考えています。
| 