Research
β-マンナン代謝に寄与するマンノシドホスホリラーゼの構造と機能に関する研究
マンノシルグルコースホスホリラーゼ (MGP) とβ-1,4-マンノオリゴ糖ホスホリラーゼ (MOP) は,β-マンナンの代謝に働く酵素です.これらの酵素は共にアミノ酸配列に基づき糖質加水分解酵素ファミリー130に分類されており,本ファミリーの中ではMGPはサブファミリー1 (GH130_1) に,MOPはサブファミリー2 (GH130_2) に分類されています.
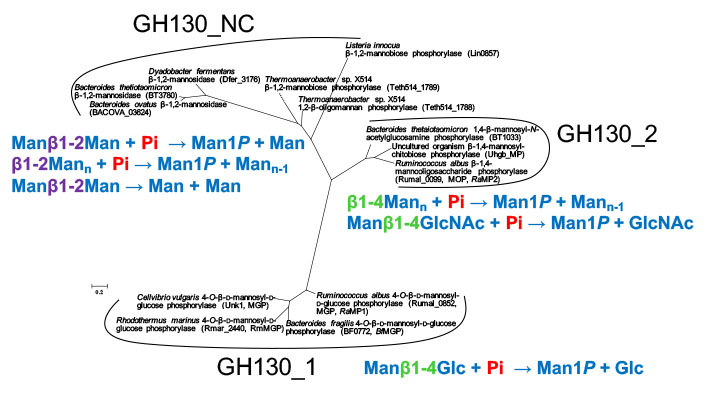
GH130の分子系統樹
私たちはこれまでにRuminococcus albus由来MGPのRaMP1とMOPのRaMP2の結晶構造を明らかにしました (Ye et al., FEBS Lett. 2016).両酵素共に5つのブレードと呼ばれる構造からなるβ-プロメラ構造の触媒ドメインを持ち,RaMP1はホモ3量体,RaMP2はホモ6量体です.
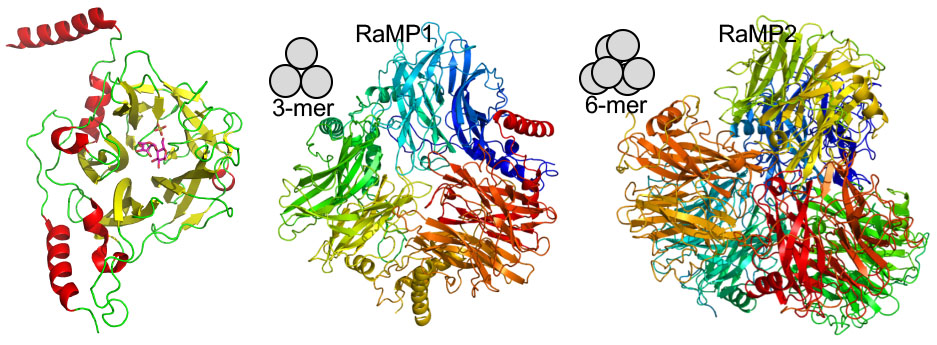
RaMP1のモノマーの構造 (左) とRaMP1とRaMP2の全体構造 (中央と右)
RaMP1とRaMP2の基質特異性を比較すると,RaMP1は二糖に,RaMP2は三糖以上の重合度のオリゴ糖に高い活性を持ちますので,重合度特異性が明確に異なります.2つの酵素の構造を比較すると,Loop1から3と名付けた3本のループの構造が大きく異なります.Loop3については隣の分子からのループです.RaMP1では,これらのループにより基質結合部位が狭められ,+2以降のサブサイトの形成が妨げられていますが,RaMP2ではこれらのループによる立体障害がなく,長鎖の基質との結合に適した広い基質結合部位を持つことがわかりました.これらの構造の違いが基質鎖長への特異性の違いを導くと考えられます.その他,これらの酵素における機能に重要なアミノ酸残基の解析を進めています.
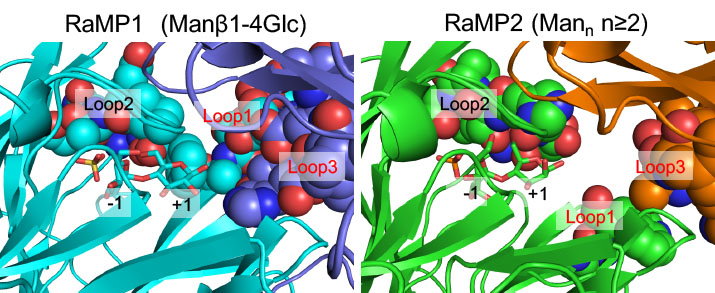
RaMP1とRaMP2の基質結合部位の構造の比較
ループ1から3のアミノ酸残基をボールモデルで表示した.RaMP1ではこれらのループにより二糖への高い特異性が発揮されている.
生物化学研究室のホームページへようこそ。当研究室に関する情報をお知らせしています。