Research
セロビオース2-エピメラーゼの構造と機能に関する研究
セロビオース2-エピメラーゼ (CE) はウシなどの反芻動物の第一胃ルーメンに生息する絶対嫌気性細菌Ruminococcus albusに見出された酵素であり,セロビオースの還元末端グルコース残基をマンノース残基に異性化する反応を触媒します。これまでに知られている糖質の異性化を触媒する酵素 (エピメラーゼ,イソメラーゼ) の中でオリゴ糖の非アノメリック位の水酸基のエピメリ化を触媒する酵素はCEのみであり,ユニークな存在の酵素と言えます。私たちは,2007年に本酵素の単離,遺伝子のクローニングに成功し,その一次構造を明らかにしました (Ito S. et al., Biochem. Biophys. Res. Commun., 2007).本酵素のアミノ酸配列は,N-アセチルグルコサミンをN-アセチルマンノサミンに異性化するアシルグルコサミン2-エピメラーゼやグルコース,マンノース,フルクトースの間の相互変換を触媒するアルドース-ケトースイソメラーゼとわずかながら類似性を示します.大腸菌による組換え酵素を用いて基質特異性を検討すると,CEはセロビオース以外にβ1-4結合からなるマンノビオースやラクトース (乳糖) にも作用できることがわかりました (Ito, et al., Appl. Microbiol. Biotechnol., 2008).
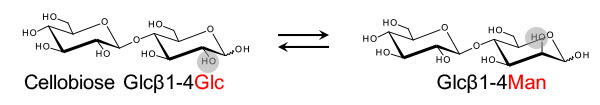
CEの反応
R. albus由来CEの配列を基に配列を検索すると,CEはBacteroides fragilisなどの嫌気性細菌だけでなく (Senoura, et al., Biosci. Biotechnol. Biochem., 2009),Rhodothermus marinus (Ojima & Saburi et al., Biosci. Biotechnol. Biochem., 2011) やFlavobacterium johnsoniae (Ojima et al., Biosci. Biotechnol. Biochem., 2013) などの好気性細菌にも存在することがわかりました.このことは,CEはルーメンという特殊な環境で生育する細菌に見出された酵素ですが,様々な環境に生育する多様な微生物が持つ糖質代謝系で機能することを意味します.CEが関与する糖質代謝系については“ルーメン細菌Ruminococcus albusにおけるセロビオース2-エピメラーゼと二つのマンノシドホスホリラーゼによるマンナン代謝”で紹介しています.
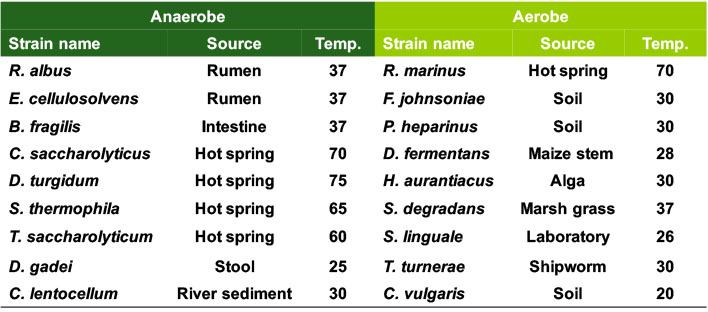
CE生産菌の分布
さて,私たちは,北海道大学大学院生命科学院X線構造生物学研究室の姚先生の研究グループと共同でR. albusとR. marinus由来CEの結晶構造を明らかにすることに成功しました (Fujiwara, et al., FEBS Lett., 2013; Fujiwara, et al. J. Biol. Chem., 2014).これらの酵素はいずれも内側に6本,外側に6本のα-へリックスから構成される (α/α)6バレルというフォールドからなる触媒ドメインを持つことがわかりました.これらの構造は,低いながらもCEとの配列類似性を示したN-アシルグルコサミン2-エピメラーゼ (AGE) やアルドース-ケトースイソメラーゼ (AKI) の結晶構造とよく似ています.
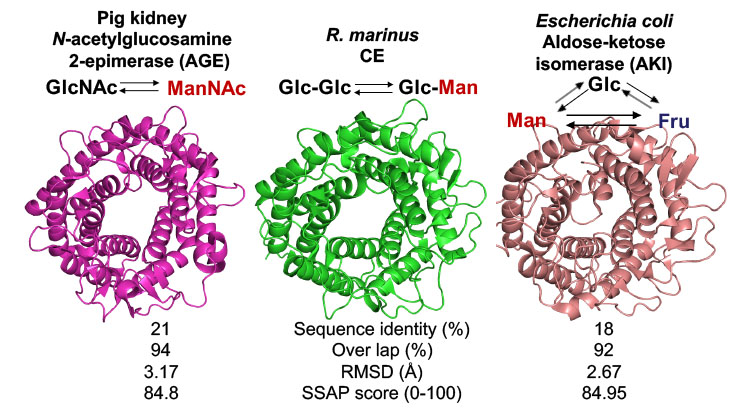
CE,AGEおよびAKIの全体構造の比較
活性中心と推定されている2残基のHis残基はいずれの酵素においても空間的によく似た位置に配置されており,これらの酵素は同様なメカニズムで反応を触媒すると考えられました.重水中でCE反応を行うと還元末端等残基の2位のHがDに置き換わることが知られており,CEの反応では酵素の一般塩基触媒によりプロトンが引き抜かれ,一般酸触媒によりプロトンが与えられると考えられています.セロビイトール (セロビオースを還元して得られる糖アルコールで開環構造を持つ.基質にはならない) とR. marinus由来CEの複合体構造を解析した結果,セロビイトールの糖アルコール部分の2位炭素が2残基の触媒Hisのちょうど中間に位置することがわかりました.糖アルコール部分の2位プロトンとの位置関係からHis390が還元末端グルコース残基からプロトンを引き抜きcis-エンジオール反応中間体を導く一般塩基触媒,His259が反応中間体の2位炭素にプロトンを与えてマンノース残基を生成する一般酸触媒として働くと推定されました.
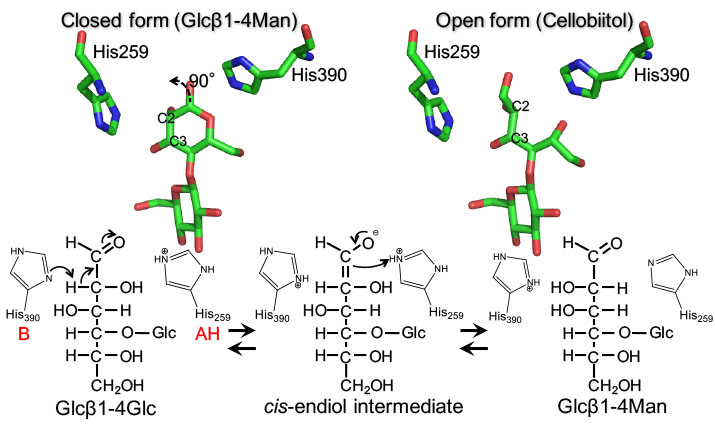
構造から推定されたCEの反応機構
生物化学研究室のホームページへようこそ。当研究室に関する情報をお知らせしています。