Research
セロビオース2-エピメラーゼとホスホリラーゼによるβ-マンナンの代謝
セロビオース2-エピメラーゼ (CE) 生産菌における周辺遺伝子を調べると,Bacteroides fragilisでは,CE遺伝子の周辺にβ-マンナンを二糖単位で加水分解するβ-マンノビオヒドロラーゼとマンノシルグルコース (Manβ1-4Glc) を加リン酸分解する新規酵素マンノシルグルコースホスホリラーゼをコードする遺伝子が見出されました (Senoura, et al., Biochem. Biophys. Res. Commun., 2011).このことは,CEがマンナンの代謝において加水分解により生成したマンノビオースをManβ1-4Glcに変換し,その後の加リン酸分解へと導く機能を担うことを示しています.好気性細菌のRhodothermus marinusやCellvibrio vulgarisにおいてはB. fragilisで見られたような遺伝子クラスターが見つかりましたが,R. albusにはCE遺伝子の周辺にこれらの酵素遺伝子は存在しません.
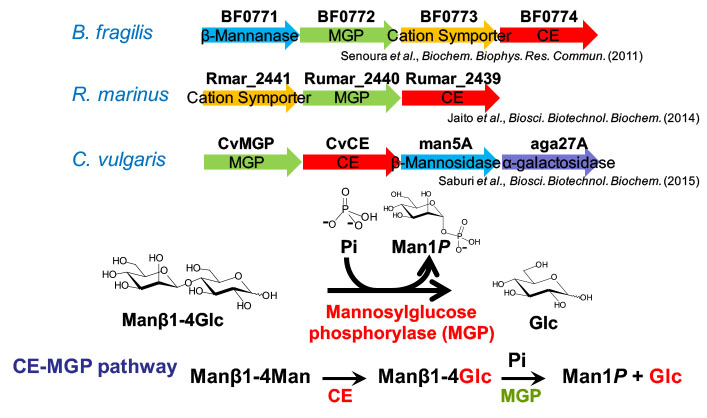
CEとマンノシルグルコースホスホリラーゼによるマンノビオースの代謝経路 (CE-MGP経路)
R. albusの無細胞抽出液中のManβ1-4Glc加リン酸分解活性を調べると,酵素活性は確かに検出されます.この活性を指標に酵素の精製を行ったところ,2つの酵素,RaMP1とRaMP2が得られました.これらの酵素をコードする遺伝子をクローニングし,大腸菌を用いて生産した組換え酵素の性質を調べると,RaMP1はB. fragilisに見られた酵素と同様のマンノシルグルコースホスホリラーゼであり,RaMP2はマンノシルグルコースよりむしろ3糖以上のマンノオリゴ糖をよく加リン酸分解する新規酵素 (β-1,4-マンノオリゴ糖ホスホリラーゼ) であることがわかりました。
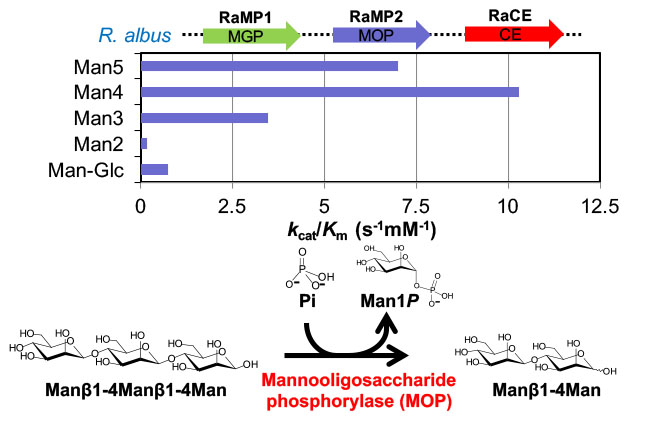
β-1,4-マンノオリゴ糖ホスホリラーゼ RaMP2の基質特異性
このことから,R. albusのマンナン代謝においては,B. fragilisで考えられた経路に加えて,長鎖マンノオリゴ糖の加リン酸分解が機能していると考えられました (Kawahara & Saburi, et al., J. Biol. Chem., 2012).この成果については北海道大学のプレスリリースにて発表され,新聞各紙にて報道されました.
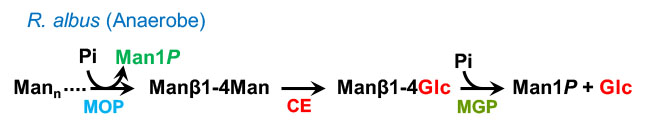
R. albusにおけるβ-マンナン代謝経路
生物化学研究室のホームページへようこそ。当研究室に関する情報をお知らせしています。