Research
Ruminococcus albusの2つのセロオリゴ糖を加リン酸分解するホスホリラーゼに関する研究
R. albusはセルロースの分解に優れた細菌であり,セルロース分解物であるセロオリゴ糖の菌体内での代謝には加リン酸分解酵素が主に働いていることが提唱されています.セロオリゴ糖の代謝に重要であるにもかかわらず,これまで生化学的機能は調べられていませんでした.セロオリゴ糖の加リン酸分解を触媒する酵素はアミノ酸配列から糖質加水分解酵素ファミリー94に分類されており,R. albusはこのファミリーの酵素をコードする遺伝子を2つ持ちます.私たちはこれらの酵素遺伝子を大腸菌にて発現させ,組換えタンパク質を用いて酵素化学的諸性質を解析しました.その結果,Rumal_0187にコードされるタンパク質はセロビオースを加リン酸分解するセロビオースホスホリラーゼであり,Rumal_2403にコードされる遺伝子は3糖以上のセロオリゴ糖をよく加リン酸分解するセロデキストリンホスホリラーゼであることがわかりました.
セロビオースホスホリラーゼについては,逆反応,すなわちグルコース1-リン酸 (ドナー) とグルコース (アクセプター) からのセロビオースと無機リン酸の生成を解析すると,グルコースがグルコース1-リン酸結合部位に結合して競争的に反応を阻害するだけでなく,酵素-グルコース-グルコース1-リン酸の3者複合体に結合することにより不拮抗阻害剤としても働くことがわかりました (Hamura & Saburi, et al., Biosci. Biotechnol. Biochem., 2012).
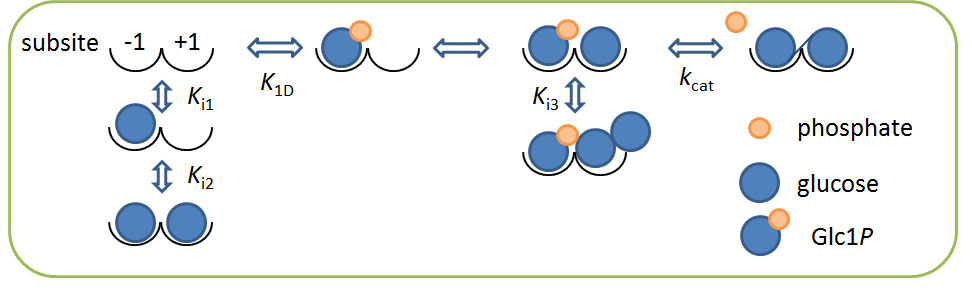
R. albus由来セロビオースホスホリラーゼの逆反応で見られたグルコースによる阻害モデル
また,セロビオースホスホリラーゼのアクセプタ―結合部位においてグルコースの2-OHと水素結合を形成するTyr648をPheに置換することによりマンノースを,Valに置換することによりN-アセチルグルコサミンをアクセプターとした合成活性を飛躍的に向上させることに成功しました (Hamura & Saburi, et al., Carbohydr. Res., 2013).これは,野生型酵素では大量合成が難しかったオリゴ糖の効率合成を可能とします.
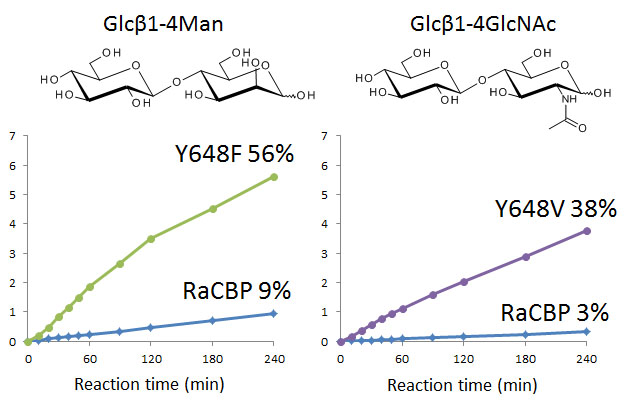
変異型セロビオースホスホリラーゼを利用したオリゴ糖の合成
セロデキストリンホスホリラーゼは,加リン酸分解においてセロオリゴ糖の中ではセロヘキサオースを最もよい基質としました (Sawano & Saburi, et al., FEBS J., 2013).また,この酵素はこれまでに知られている糖質ホスホリラーゼと比較してリン酸に対する親和性が極端に低いことがわかりました.逆反応を利用してアクセプター特異性を検討すると,本酵素はセロオリゴ糖だけでなく,マンノオリゴ糖も受容体としました.このことはこのセロデキストリンホスホリラーゼがセロオリゴ糖だけでなく,グルコマンナン分解物のような複合オリゴ糖の分解にも寄与している可能性を示唆しています.
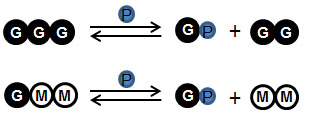
R. albus由来セロデキストリンホスホリラーゼのオリゴ糖への作用
この酵素のアミノ酸配列を他の酵素と比較すると,上記セロビオースホスホリラーゼのTyr648に相当する位置にPhe633を有していることがわかり,変異酵素の解析により当該残基がマンノオリゴ糖をアクセプターとする合成活性に重要であることが示されました.興味深いことにPhe633をTyrに置換した酵素ではリン酸に対する親和性が他の糖質ホスホリラーゼと同等レベルまで向上することがわかりました.すなわち,アクセプター結合部位のTyrによる水素結合ネットワークがリン酸結合部位におけるリン酸基への親和性に関与することが示唆されました.
生物化学研究室のホームページへようこそ。当研究室に関する情報をお知らせしています。