Research
ユニークなドメイン構成を持つ耐熱性耐アルカリ性α-アミラーゼに関する研究
液化型のα-アミラーゼは,澱粉汚れを除去するための洗剤用添加剤として有用です.従来はアルカリ性,キレート剤存在下で高い活性を持つ酵素が使用されてきましたが,近年の高温で運転される自動食器洗浄機の普及により,耐熱性を併せ持つ酵素が求められています.私たちは土壌細菌Bacillus sp. AAH-31から耐熱性,耐アルカリ性,耐キレート剤液化型α-アミラーゼ (AmyL) を発見しました (Kim & Morimoto, et al., Biosci. Biotechnol. Biochem., 2012).
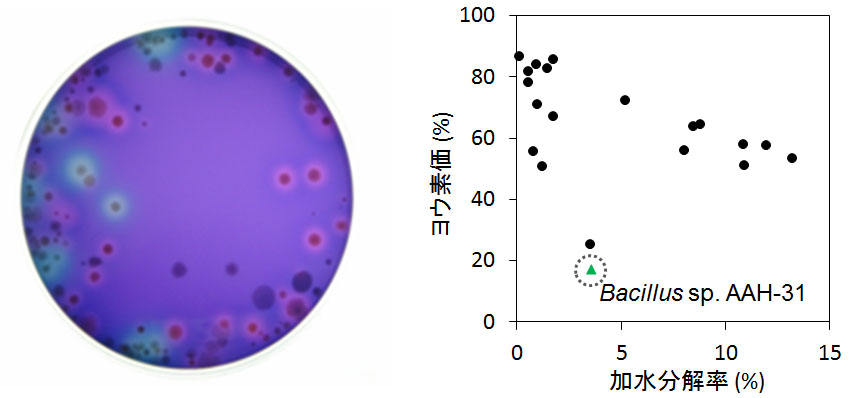
AmyLのスクリーニング
澱粉を分解するとコロニーの周りに分解斑が形成されるシクロデキストリンを合成する酵素では色素が包接されて透明の分解斑,加水分解酵素ではピンク色の分解斑ができる (左図).澱粉を効率的に低分子化する液化型酵素を用いると加水分解率が低くてもヨウ素価が大きく低下する (右図).
AmyLは,91 kDaのモノマーであり,他の細菌由来のα-アミラーゼよりも分子量が大きい酵素です.AmyL遺伝子をクローニングして推定アミノ酸配列を明らかにすると,興味深いことにAmyLは,ネオプルラナーゼ様の触媒ドメイン,N末端側に糖質結合モジュールファミリー20に分類される糖結合ドメイン (CBM20),および2つの機能未知ドメインからなることがわかりました (Saburi & Morimoto, et al., Biosci. Biotechnol. Biochem., 2013).N末端側の糖結合ドメインについては,部位特異的変異酵素の解析を通じて,CBM20でよく保存されているサイト1と呼ばれる糖結合サイトが高分子基質への親和性に重要な働きを持ちます.ネオプルラナーゼにおいてN末端にCBM20を持つ酵素が知られていないこと,2つの機能未知ドメインがAmyLのC末端側に見られたことから,AmyLは新しいドメイン構成を持つ酵素であると考えられました.ネオプルラナーゼ様触媒ドメインを持つにもかかわらず,プルラン分解活性を持たない点で,AmyLは機能的にも明確にネオプルラナーゼとは区別されます.このAmyLの高機能化を企図してタンパク質工学的手法,進化工学的手法により基質結合部位を構成するアミノ酸残基を最適化し,野生型酵素の3.4倍の酵素活性を持つ変異酵素の開発に成功しました (Tamamura & Saburi, et al., Biochem. Engin. J., 2014).これらの研究はADEKAクリーンエイドおよびADEKAとの共同研究で行われました.
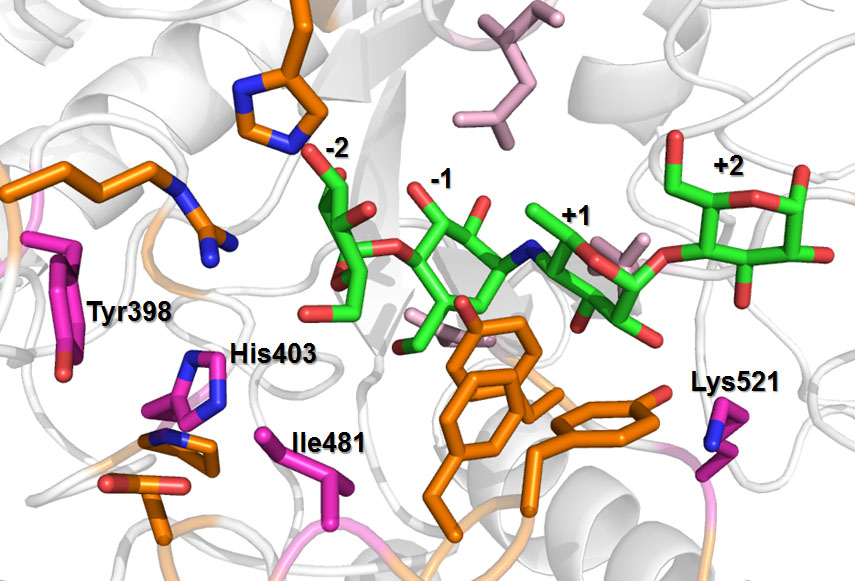
AmyLの基質結合部位の推定構造
マジェンタはAlaへの置換により活性が大きく上昇した部位を示す.オレンジは変異導入候補残基,ピンク色は活性残基を示す.緑の分子は基質アナログを示し,マイナスが非還元末端側,プラスが還元末端側.
生物化学研究室のホームページへようこそ。当研究室に関する情報をお知らせしています。