
植物機能学専門分野 研究の概要

教授
増田 清 (Kiyoshi MASUDA)
連絡先 : kmasuda●res.agr.hokudai.ac.jp (●をアットマークに変えてご使用ください)
(山岸准教授の研究内容紹介はこちら→●)
核と細胞質の間にあるもの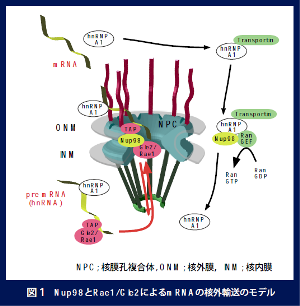
真核生物の原形質は二重膜(核二重膜)によって細胞質と核質に仕切られています。核二重膜,それを補強する(裏打ちする)核ラミナ,核膜を通した高分子物質のやりとりに機能する核膜孔複合体をあわせて,核膜(エンベロープ)といいます。以前からフコースを認識するハリエニシダレクチン(UEA-1)が核の周縁部と特異的に反応することがわかっていました。UEA-1の核表層との反応は、Nuclease, 0.5M NaCl, Triton X-100処理などによっても変化が見られなかったことから、UEA-1は核膜の構造に関連する分子と反応していると想像されました。そこで、ニンジンの細胞からUEA-1と反応するタンパク質を抽出し、部分精製してそのアミノ酸配列を調べました。その結果、このタンパク質はヌクレオポリンの一種NUP98であり,その糖鎖部分がUEA-1と反応することがわかりました。
核の中で作られるmRNAは核膜孔複合体を通して細胞質に運ばれます。一方核の中で働くタンパク質は細胞質で作られたあと核内に運び込まれます。これら核膜を通して分子を輸送する構造が核膜孔複合体です。核膜孔複合体は8個のサブユニットが同心円状に並ぶ八量体の巨大構造で,それぞれのユニットは数十種類のヌクレオポリンと呼ばれるタンパク質からなります。NUP98は多くの他の因子とともにmRNAの核外輸送に関わっていることがわかっていますが,その仕組みは複雑で,全貌はいまだ明らかになっていません。私たちは,NUP98とそれと結合する因子RAE1/GLE2の機能を明らかにすることによって,植物におけるmRNAの核外輸送の一端を明らかにしようとしています。
 動物では細胞核の分裂にともなう核膜の崩壊と再構成にラミンが重要な役割を果たしています。ラミンは脊椎動物などの核ラミナを構成する主要タンパク質です。ラミンは細胞骨格の一つ,中間径フィラメントを構成するタンパク質です。つい最近まで、多くの人が植物ラミンの存在を信じ、その検出を試みていました。実際植物ラミンの存在を示唆する報告も多くありました。しかしシロイヌナズナ遺伝子のデータベースを検索しても、ラミン類似の遺伝子はありませんでした。そればかりか中間径フィラメントタンパク質に関連するタンパク質の遺伝子も見つかっていません。
動物では細胞核の分裂にともなう核膜の崩壊と再構成にラミンが重要な役割を果たしています。ラミンは脊椎動物などの核ラミナを構成する主要タンパク質です。ラミンは細胞骨格の一つ,中間径フィラメントを構成するタンパク質です。つい最近まで、多くの人が植物ラミンの存在を信じ、その検出を試みていました。実際植物ラミンの存在を示唆する報告も多くありました。しかしシロイヌナズナ遺伝子のデータベースを検索しても、ラミン類似の遺伝子はありませんでした。そればかりか中間径フィラメントタンパク質に関連するタンパク質の遺伝子も見つかっていません。
陸上植物はシャジク藻に近縁の古い種から進化したと考えられています。その根拠の一つとして、藻類の仲間ではシャジク藻が開放型の核分裂をする、という細胞分裂上の特徴が挙げられています。それ以外の藻類はくびれによる核分裂、つまり細部分裂の過程を通して核膜が消失しない,いわゆる閉鎖型の有糸分裂をします。つまり、シャジク藻が出現する以前の植物はすべて閉鎖型核分裂をしていたと考えられます。植物が「開放型の核分裂」という仕掛けを思いつく以前に、すでに動物に進むグループと植物に進むグループが生まれていたでしょうから、開放型核分裂の仕組みは、動物と植物で全く独立に発達したということになります。核の基本構造に関与する分子の違いは一応そのように説明できますが,確かな根拠を見つけることが必要です。
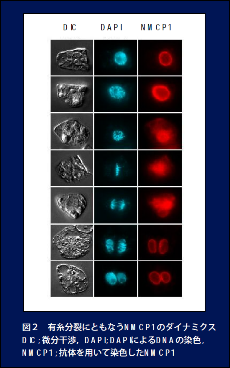
ニンジンでは核の内膜に接してNMCP1というタンパク質があります。このタンパク質は分子量がラミンの2倍ほどありますが、中央のcoiled-coil領域をhead domainとtail
domainが挟む3部構成をとることなどから、核膜裏打ちタンパク質として機能していることに間違いはなさそうです。事実,細胞分裂前期に分裂期細胞質に分散し、分裂後期に染色体の表層に集積し始めるなど、ラミンBと類似した性質を持つことがわかっています。シロイヌナズナをはじめとして多くの植物でNMCP1が同定されています。NMCP1は中間径フィラメントタンパク質ではなく,類縁のものは遺伝的に変異の著しいユニークな一群を形成しています。最近,NMCP1と似た構造のNMCP2を同定しましたので,両者の違いに視点をおき,ダイナミクスなどの解析を進めているところです。
アスパラガスには雄性と雌性があります。最近、実験農場で維持されているアスパラガス系統のなかに花の形態がホメオティックに変異したものがみつかりました。その系統の花は雄蕊が雌蕊化し、花被が著しく小型化しています。高等植物の花は形態学的に基本的な四つのwhorl(輪生)から構成され、その形態形成はMADS-Box遺伝子によって制御されています。この遺伝子はA,B,C三つのクラスからなり、Aのみが発現するとがくが、AとBが発現すると花弁が、BとCが発現すると雄蕊が、Cのみが発現すると雌蕊が形成されることがわかっています。このような,花器官分化とMADS-Box遺伝子の発現との関連から、見つかったアスパラガスのホメオティック変異体はBクラス遺伝子の機能不全に起因していると想像されました。事実この変異体ではノーザン解析やin situでの発現解析から、変異した花芽でのB遺伝子の転写低下が認められます。
アスパラガスは雌雄異株植物です。植物体には雌花と雄花が着生しますが、成熟した雌花,雄花には雄蕊あるいは雌蕊の痕跡が残ります。花の性は,性表現に対抗する花器官の発育が停止によって生じますので,発達初期の段階で生長が停止した雄蕊あるいは雌蕊が残ることになります。このような発育不全はWhorlによらず,分化した花器官のタイプによることがアスパラガスのホメオティック変異体の花を調べてわかりました。雌花のwhole3に形成された花器官はやがて発育不全を起こします。見つかったホメオティック変異体は遺伝的には雌で,だとするとwhole3に形成された心皮は発育不全を起こすはずです。しかし,実際はwhole3に形成された花器官(雌蕊)は退化することなく成熟に至りました。
アスパラガスは遺伝的にXY型の遺伝様式を示しますが,性染色体を形態的な違いから識別することはできません。アスパラガスは雄性が経済栽培に利用されるため,雌雄の遺伝的な判別は,開花前植物体での雌雄判別は応用的に価値があります。この判別にはY因子と強く連鎖するDNAマーカーが利用され,現在ではほぼ100%の確立で,雌雄の判別が可能となっています。不思議なことにアスパラガスではまれに雄性株に受精・結実能力のある雄性花が着生します。このような花が生じる原因は,性に対抗する花器官の発育不全が不完全におこるからだと考えられます。花器官の退化を引き起こす仕組みの解明が必要ですが,同時に,性決定因子(X,Y)は一体何をしているのだと,改めて考えさせられてしまいます。
分化全能性とは関係なさそうだけど
植物の体細胞は分化全能であると考えられていますが、実際に全能性を発現させることのできる植物種は限られています。組織培養での植物の発生制御をより多くの植物で可能にするためには、脱分化や再分化の際に組織の中で何が起きているのかをもっとよく知る必要があります。私たちは、ホウレンソウの根切片を用い、培地に加える成長調節物質を調節することによって、体細胞胚を分化する細胞と分化しない細胞を作り分ける方法を確立しました。この系で、胚を作る細胞と作らない細胞に含まれるタンパク質を比較したところ,胚を作る細胞ではリボソーム不活性化タンパク質(Rip)の著しい蓄積のあることがわかりました。Ripは生物毒の一種で、広範な植物種でその産出が確認されています。その代表的なタンパク質はトウゴマ(Ricinus communis)種子に含まれるリシンです。
Ripの知られている毒性はリボソームRNAの特定部位の切断です。切断される部位はエロンゲーションファクター結合部位であるため、結果としてタンパク質合成能が失われます。Ripの活性は病原菌の感染を抑制する働きもありますが,ホウレンソウで作られるタイプのRipは,胚形成における分裂組織での活性調節と正常な形態形成に働いていると考えています。ホウレンソウの胚では発生段階に応じて,2種類のRip遺伝子(SoRip1とSoRip2)が発現します。胚におけるRipの機能とその発現調節について,多いに興味がもたれるところです。
おわりに — 生物は手近にある物を使う
植物は環境ストレスから自己を防御するための高度に発達したシステムをもっています。それらは発育や環境変化に依存して発現します。たとえば、種子では成熟にともなって、細胞に乾燥に耐えるための変化が生じます。また、温帯に生育する植物は、冬に向かう環境変化によって糖やタンパク質を蓄積したり膜脂質の組成を変化させます。細胞は含水率を低下させることによって、低温や凍結による障害を回避しますが、そのためには、乾燥への抵抗性を高めなければなりません。
ハスカップやハイブッシュ・ブルーベリーなどのブッシュを用いて調べたところ、凍結耐性の増加と連動して、細胞内に数種のタンパク質が蓄積することがわかりました。しかし、同定されたそらのタンパク質のうち、最も顕著に変動するものは、一見低温耐性と関連性のなさそうなタンパク質でした。このことは、不利な環境の変化に抵抗するための特別なタンパク質を発現するのではなく、手持ちのタンパク質のなかから使えそうなものを必要に応じて利用するという、植物の卓越した適応性(場当たり主義)を例示しているように思えます。それは、動くことの出来ない植物が、遭遇する多様な環境変化に対応するための膨大な遺伝子を準備することなく生き延びる、植物の知恵なのかもしれません。生物としての普遍性と植物としての特殊性,その理解が植物機能の解明におおいに役立つと考えています。
論文等
K. Masuda, S. Takahashi, K. Nomura and M. Inoue (1991). A simple procedure for the isolation of pure nuclei from carrot embryos in synchronized cultures. Plant Cell Reports 10, 329-333.
K. Masuda, S. Takahashi, K. Nomura, M. Arimoto and M. Inoue (1993). Residual structure and constituent proteins of peripheral framework of the cell nucleus in somatic embryos from Daucus carota L. Planta 191, 532-540.
E. Ito, M. Inoue, K. Nomura, S. Takahashi, K. Oshima and K. Masuda (1994). An efficient procedure for plant regeneration from long-term-cultured callus tissue of hybrid poplar (Populus sieboldii Miq. x Populus grandidentata Michx.). Plant Tissue Culture Letters 11, 184-189.
F. Komai, K. Masuda, T. Harada, I. Okuse (1996). Plant regeneratoin from adventitious roots of spinach (Spinacia oleracea L.) grown from protoplasts. Plant Science 120, 89-94.
K. Masuda, Z.-J. Xu, S. Takahashi, A. Ito, M. Ono, K. Nomura, M. Inoue (1997). Peripheral framework of carrot cell nucleus contains a novel protein predicted to exhibit a long alpha-helical domain. Experimental Cell Research 232, 173-181.
K. Nomura, W. Saito, K. Ono, H. Moriyama, S. Takahashi, M. Inoue and K. Masuda (1997). Isolation and characterization of matrix associated region DNA fragments in rice (Oryza sativa L.). Plant and Cell Physiology 38, 1060-1068.
H. T. Imanishi, T. Suzuki, K. Masuda and T. Harada (1998). Accumulation of raffinose and stachyose in shoot apices of Lonicera caerulea L. during cold acclimation. Scientia Horticulturae 72, 255-263.
K. Nomura, S. Matsumoto, K. Masuda and M. Inoue (1998). Reduced gluthatione promotes callus growth and shoot development in a shoot tip culture of apple root stock M26. Plant Cell Reports 17, 597-600.
H. Imanishi, T. Kawaguchi, T. Suzuki, K. Masuda and T. Harada (1999). Accumulation of raffinose during cold acclimation in Lonicera caerulea L. plantlets cultured in vitro. Cryo-Letters 20, 235-242.
F. Komai, K. Masuda, T. Ishizaki and T. Harada (1999). Sex expression in plants regenerated from the root callus of female and male spinach (Spinacia oleracea ). Plant Science 146, 35-40.
K. Masuda, S. Haruyama and K. Fujino (1999). Assembly and disassembly of the peripheral architecture of the plant cell nucleus during mitosis. Planta 210, 165-167.
T. Ishizaki, F. komai, C. Megumi and K. Masuda (2000). Exogenous ethylene enhances formation of embryogenic callus and inhibits embryogenesis in cultures of explants of spinach roots. Journal of the American Society for Horticultural Science 125, 21-24.
H. Imanishi, K. Takada, K. Masuda, T. Suzuki and T. Harada (2000). The use of callus cultures for searching proteins associated with increased freezing tolerance during cold acclimation in Lonicera caerulea L. Plant Biotechnology 17, 21-25.
M. Ebi, N. Kasai, K. Masuda (2000). Small inflorescence bulbils are best for micropropagation and virus elimination in garlic. HortScience 35, 735-737.
M. Ono, K. Sage-Ono, M. Kawakami, M. Hasebe, K. Ueda, K. Masuda, M. Inoue, H. Kamada (2000). Agrobacterium-mediated transformation and regeneration of Pharbitis nil. Plant Biotechnology 17, 211-216.
M. Nishiwaki, K. Fujino, Y. Koda, K. Masuda, Y.Kikuta (2000). Somatic embryogenesis induced by the simple application of abscisic acid to carrot (Daucus carota L.) seedlings in culture. Planta 211, 756-759.
T. Ishizaki, F. komai, and K. Masuda (2001). Screening for strongly regenerative genotypes of spinach in tissue culture using subcultured root explants. Plant Cell, Tissue and Organ Culture 67, 251-255.
T. Ishizaki, C. Megumi, F. komai, K. Masuda and K. Oosawa (2002). Accumulation of a 31-kDa glycoprotein in association with the expression of embryogenic potential by spinach callus in culture. Physiologia Plantarum 114, 109-115.
Z.-J. Xu, K. Ueda, K. Masuda, M. Ono and M. Inoue (2002). Molecular characterization of a novel protein disulfide isomerase in carrot. Gene 284, 225-231.
T. Ishizaki , Y. Hoshino, K. Masuda and K. Oosawa (2002). Explants of Ri transformed hairy roots of spinach can develop embryogenic calli in the absence of gibberellic acid, an essential growth regulator for induction of embryogenesis from nontransformed roots. Plant Science 163, 223-231.
F. Komai and K. Masuda. (2002). Somatic embryogenesis in Spinacia oleracea L. Current Topics in Plant Biology 3, 187-197.
F. Komai and K. Masuda (2004). Plasticity in sex expression of spinach (Spinacia oleracea L.) regenerated from root tissues. Plant Cell, Tissue and Organ Culture 78, 285-287.
N. Murata, K. Masuda, R. Nishiyama and K. Nomura (2005). Construction of a micro-library enriched with genomic replication origins of carrot somatic embryos by laser microdissection. Plant Physiology and Biochemistry 43, 513-519.
Y. Asada, N. Kasai, Y.Adachi, A. Kanno, N. Ito, P.-Y. Yun and K. Masuda (2006). A vegetative line of asparagus (Asparagus officinalis) with a homeotic change in flower development is correlated with a functional deficiency in class-B MADS-box genes. Journal of Horticultural Science & Biotechnology 81, 874-882.
K. Ishibashi, K. Masuda, S. Naito, T. Meshi and M. Ishikawa (2007). An inhibitor of viral RNA replication is encoded by a plant resistance gene. Proceedings of the National Academy of Sciences,
K. Zhou, M. Yamagishi, M. Osaki and K. Masuda (2008). Sugar signalling mediates cluster root formation and phosphorus starvation-induced gene expression in white lupin. Journal of Experimental Botany 59, 2749-2756,
K. Kawade, T. Ishizaki and K. Masuda (2008). Differential expression of ribosome-inactivating protein genes during somatic embryogenesis in spinach (Spinacia oleracea). Physiologia Plantarum 134, 270-281.
T. Kikuchi and K. Masuda (2009). Class II chitinase accumulated in the bark tissue involves with the cold hardiness of shoot stems in highbush blueberry (Vaccinium corymbosum L.). Scientia Horticulturae 120, 230-236.
K. Kawade and K. Masuda (2009). Transcriptional control of two ribosome-inactivating protein genes expressed in spinach (Spinacia oleracea) embryos. Plant Physiology and Biochemistry 47, 327-334.