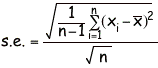君たちがまず知らなければいけないこと。
生物機能化学科学生実験
土壌学分野・作物栄養学分野担当教官
倉持寛太、中原治(土壌学分野)、渡部敏裕、信濃卓郎(作物栄養学分野)
実験の心得
(1)一般的心得
実験で用いる多くの試薬類は毒性の強いものが多く、不用意に皮膚に接触させたり、口に入れることは決してしないように注意すること。また、一般試薬でも濃度が高い場合には強い毒性を示し、場合によっては発ガン性を持つ場合があるので十分に留意すること。実験室内での飲食、食品の保管、喫煙は厳禁とする。白衣を着用すること。土足での入室を禁止するので、各自上履きを用意すること。携帯電話の室内での使用は禁止します。電源は入れていても良いですが、計算機能も含めて室内で使用はしないこと。実験の進め方を自分達で考えるのは大変良いが、偏った時間配分は事故にもつながりかねず、好ましくない。原則として18時に実験室は閉鎖することを予め考慮すること。欠席あるいは遅刻する場合には連絡を入れること。
(2)分析上の心得
(1)標準試薬(standard)作成や定量分析のための秤量は特に正確に行う。実験は再現性があることが重要であることを常に頭に入れること。厳密な定量の場合、試薬や試料は秤量管に入れ、加熱が可能な場合は80-100˚C程度(試薬、試料に応じて異なる)で4-6時間(水分が多い場合はそれに応じてのばす)乾燥し、シリカゲル(青色であることを確認のこと)が入ったデシケーター中で放冷した後で秤量する。さらに30分間加熱し、同様に放冷後秤量し、前に秤量した値と同じになるまでこの操作を繰り返す。以上の操作を恒量という。
(2)試薬の溶解はビーカーあるいは三角フラスコ内で行い、メスシリンダーおよびメスフラスコ内で行わないこと。試薬の撹拌はガラス棒を用い、金属製のスパチュラは原則として使用してはいけない。
(3)メスシリンダー、メスフラスコ、メスピペット、ホールピペットは使用後直ちに水、脱塩水で洗浄し、風乾する(熱をかけるのは原則として禁止。ただし器具を滅菌する必要があるときは乾熱滅菌やオートクレーブを行う)。
(4)ガラス器具は使用後なるべく迅速に水道水と洗剤を用いて洗浄し、水道水で最低10回(泡がきれてから)、脱塩水で6回洗浄してから乾燥する。洗剤は残存した場合は以後の実験に影響を与えるので、必要最小量を使うようにこころがけること。
計量容器の取り扱いに関する基本的心得
1.計量容器のいろいろ
1−1、メスフラスコ、メスシリンダー、ピペット、ビュレットが計量容器として学生実験では使用される。また、計量容器ではないが(!!)ビーカー、フラスコ、スポイトなどにも目盛りはついている。(ビーカーなどのAPPROXの意味を何かを考えること。5%はずれている。)
1−2、材質には現在ガラス製とプラスチック製がある。ガラス製は化学薬品に侵されにくいが、割れやすい欠点がある。プラスチック製は一部の薬品を除けば耐薬品性があるうえに割れにくいが、耐熱性が低いという欠点がある。発熱すると予想される溶液を作成するときはガラス製を利用すること。また、実験書の指示に従い使い分けること。
1−3,計量容器には受用量器(そこまで入っている内容積を示す器具)と出用量器(別の容器に溶液を移した時の流出量を示す)の2種類がある。メスフラスコは受用量器であり、メスシリンダー・ピペット・ビュレットは出用量器である。つまり、後者の場合は移した後に中を洗って回収してはいけない。
1−4,溶液を作成する際に溶液が発熱あるいは吸熱する際は、温度変化による体積変化が容器および溶液に生じているため、室温付近に温度が下がるのを待って合わせる。(緩衝液のpHに影響を与える場合もある)
1−5,目盛りを読むときは視線を液面に水平にして、液面の最下部を読む。目盛りを読みとるときは付してある目盛りより一桁下の位まで読むこと。
2.メスフラスコについて
2−1、体積許容差が約±0.12cm3の精度を持つ(100mlの場合)。
3.メスシリンダーについて
3−1、体積許容差が約±0.5cm3程度である(100mlの場合)。
4.ピペットについて
4−1、ホールピペット、メスピペットのいずれにおいても体積許容差は±0.02cm3である(ただし前者は1-25cm3用、後者は1-5cm3用の場合)。
4−2、内壁に付いている分までは流し出さない。
4−3、ピペットの先端はビーカーやフラスコの底まで深く入れて液を吸うようにこころがけること。
4−4、駒込ピペットは目盛り付きスポイトであって、計量容器ではない。
5.ビュレットについて
5−1、体積許容差は5-25cm3用で約±0.02cm3である。
なお、容量器の検定公差(体積許容差)は容量によって異なっている。詳細を知るためにもお勧めの本は「新版 続・実験を安全に行うために」(化学同人)。また、試薬などに関しての詳細は「新版 実験を安全に行うために」(化学同人)が最適です。
薬包紙の使い方
ろ紙とロウトの使い方






ろ紙を4つ折りにして開くわけだから円周2πrの半分が円錐の底面の周長になります。
|
|

 化学実験で使うロウトの形は頂角60°の円錐形に決まっています。また、ロウトにあわせてろ紙を選ぶ時にはロウトの口径の2倍以下の直径のものを選びます。
化学実験で使うロウトの形は頂角60°の円錐形に決まっています。また、ロウトにあわせてろ紙を選ぶ時にはロウトの口径の2倍以下の直径のものを選びます。
|
|
|
|
|
 |
|
|
|
真横から見たら一辺rの正三角形となり頂角は60°になる。
|
|
ろ紙の折り方
(下の図は必要な試料が内側に来る場合。ろ液が必要な場合は滑らかな面を外側にすること。ただし、この場合は一旦内側にして追っ手から引っくり返しており直して手の汚れがなるべく付かないようにすること。内側にしろ、外側にしろ粗い面の繊維のくずが試料に混入しないようにするためである。)
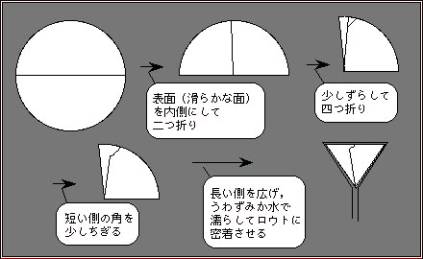
ろ紙の折り方には決まったやり方があります。
ろ過が順調に進んでいる時はロウトの足の部分にろ液の液柱ができ、この液柱の重みでろ液が吸引されることによりろ過が迅速になります。ろ液とロウトがふちのところでよく密着するようにして空位の漏れのないようにすることが重要です。
ろ液を少しずらして、4つ折りにして長い側の袋を開くことで、ろ紙の頂角を60°よりも少し広い角度にすること、また、外側の袋の角を手でちぎることは密着をよくするために大きな効果があります。ずらさないで4つ折りにしてみたり、角をちぎらないのも一度は試してみても良いです。実際に比べるとかなりの違いがあることがわかります。
電子天秤の使い方
1)天秤の底の脚を回して、 水準器の気泡が円の中心に来る ように調節する。
2)測定皿やその周囲が汚れているときは電源が切ってあることを確認の上、ガラス扉を開けて刷毛できれいにする(電源が入った状態で測定皿を掃除しないこと
)。
3)ガラス扉が閉まっていることを確認する。
4)[ON] を押して表示板にゼロが表示されるのを待つ。
5)ガラス扉を開け、薬包紙をのせてガラス扉を静かに閉める。 この時、薬包紙の四辺に折り目を付けておくとよい。対角線方向の4つの角の部分を折ると使いやすい。
6)表示が安定してから [TARE] を押すとゼロ点調節が行われて
ゼロが表示される。
7)ガラス扉を開け、静かに測定試料をのせ、ガラス扉を静かに閉める。
8)表示が安定したらその値を読みとり、ノートに記録する。
9)ガラス扉を開けて試料を取り出し、静かにガラス扉を閉める。
10)もし、試料をこぼしたり汚したときは電源を切った後で刷毛やキムワイプで慎重に掃除しておく。 汚れたままにしないこと
。
使用上の注意
1)精密機械なので取り扱いは特に慎重に(振動を与えたり、ガラス扉を乱暴に開け閉めしたりしない)。
2)設置場所は温度変化が少なく、湿度が低く、直射日光のあたらない部屋で、振動のない、水平な台の上に置くのがよい。
3)測定皿にものをのせるときは静かに行う。
4)天秤の測定上限より重いものをのせない。
5)試料は天秤の置かれた部屋の温度にしてから測定する。
6)濡れた濾紙などを直接測定皿にのせない。
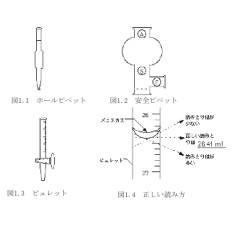
ピペットの使い方
(ホールピペットとメスピペットの二種類がある。さらにメスピペットには先端目盛型と中間目盛型がある)
1)
ホールピペット(図1.1)
ピペットの先端を液の中に入れて液を標線の数cm上まで吸い上げる.人差し指の腹面で上端を押さえて,ピペットを垂直にもって持ち上げ、ピペットの先端を液面から離してから、少しずつゆるめ,メニスカスを標線と一致させたのち,液を流出する.このとき標線を目の高さで読むようにする.ピペットの先端に残った液は,ピペットの上端を人差し指で押さえ,球部を手で握り,ピペット内部の空気を膨張させることによって押し出す.危険な試薬の場合は安全のため,液を吸い上げる際には図1.2に示した安全ピペッターを用いる.
*安全ピペッターの使用方法(図1.2)*
安全ピペッターのA,S,Eにはガラス玉が入っており,そこを強くつまむとその前後が通じる。操作手順は,まずピペットを下方から点線まで差し込む.Aをつまみながら,球の中の空気を押し出す。Sをつまみ,注意しながら徐々に試料をピペットの中に吸い込む.Eをつまみながら,試料を出す。ピペットの先端に残った液は先端を壁面に接触させながら安全ピペッターのEをあけながらそこの小さい膨らみの空気で押し出す。
4—2)メスピペット
先端目盛型はピペットの中の液を全て出してその容量となるタイプである。先端が再大容量(10mlのピペットならば10ml)となっていると認識すること。この場合、先端に残った液は上部から軽く息で押し出すこと。ホールピペットのようにあたためてはいけない。手の温度によってガラスが膨張し、体積が変わる。
中間目盛型は先端から少し上の部分に最大容量を示した線がある。先端目盛型と異なり全て吹き出してはいけない。
ビュレット(図1.3) 乾燥していない場合、水を切ってから標準溶液を1/4程度入れて3回ぐらい共洗いする(器壁についている水で滴定する溶液が希釈されないように,滴定する溶液で洗う).まずロートを上部につけゼロ点の少し上まで液を入れたのち,ロートを取り除き液を流出させ,コックの下端に空隙を生じないようにする.滴定時の溶液の滴下は徐々に行い,滴定終了後,同様に目盛りを読み記録する.目盛りを読むときは,図1.4のようにメニスカスを目の高さと一致させ,目盛りの1桁下の値まで読む.実際の操作にあたっては後述の滴定を良く読むこと。
「滴定」
0.05 Mの硫酸溶液を作成し、フタル酸水素カリウムで標定した0.1M
の水酸化ナトリウム溶液を用いて滴定し、正確な硫酸濃度を求める。
準備する試薬(各自用意)
1)0.5Mの硫酸溶液を各班100ml用意する。(100ml容メスフラスコにあらかじめ50ml程度の脱塩水を入れ、そこに安全ピペットを用い、メスピペットで濃硫酸の必要量を加える。最後に脱塩水を用いて100mlにメスアップする。)なお、濃硫酸の濃度は18Mである。濃硫酸をこぼした場合は直ちに拭き取るが、拭き取った紙、雑巾等をそのまま放置しないこと。発熱して発火する危険があるため、必ず水につけること。また、蒸発しないため、薄い溶液であっても衣服に付くと後から穴があくので注意。
次に0.5M硫酸溶液から各自0.05M硫酸溶液を作成する。0.5M硫酸溶液を10mLホールピペットを用いて100ml容メスフラスコに入れ、脱塩水を用いて100mlにメスアップする(この操作では安全ピペットを用いなくてよいが、口に入らないように注意深く操作を行なう。もし口に入った場合は水道水でよくすすぐこと)。作成した硫酸溶液は三角フラスコに入れ、パラフィルムでふたをして保管する。
2)1.0Mの水酸化ナトリウム溶液を各班100ml用意する。必要量の水酸化ナトリウムを秤取り、ビーカーを用いて50ml程度の脱塩水で溶解し、完全に溶解したら、メスフラスコを用いて脱遠水で100mlにメスアップする。水酸化ナトリウムは潮解性であるため、天秤にこぼした場合は直ちに拭き取ること。また、強アルカリであるため目などの粘液質の部位に入った場合は大量の水で直ちに洗浄し、教官に連絡すること。
次に1.0M水酸化ナトリウム溶液から各自0.1M水酸化ナトリウム溶液を作成する(方法は硫酸の希釈と同じ。安全ピペットを用いなくてよい)。硫酸同様の方法で保管する。水酸化ナトリウム溶液は大気からCO2を吸収し、NaCO3の沈澱を生じるため水酸化物イオン(OH-)濃度が徐々に低下する。そこで毎日、フタル酸水素カリウムを用いて標定する必要がある。
3)フタル酸水素カリウム。各班毎5gのフタル酸水素カリウム(分子量=204.2)を秤量管に入れ、100-110℃で3-4時間乾燥する(実験室の乾燥機を利用する。秤量管を素手で触らないこと!。必ずルツボ鋏を使うように。)乾燥後、デシケータに入れ最低15分程静置して室温にもどす(この際、熱い秤量管をデシケーターに入れてデシケーターのふたを置くと、デシケーター内部の空気が膨張してふたが落ちるので、しばらくは手でふたが落ちないように保持すること)。フタル酸水素カリウムの保管はデシケータで行い、使用する度にデシケータから取り出し、使用後はデシケータに戻す。(実験を開始するデシケーターのシリカゲルの色が青色であることを確認すること。赤色が混ざっているようであれば充分な乾燥能力は無いので、シリカゲルを取り出し、まずシリカゲルを乾燥機で一晩乾燥させる)
実験操作(各自同じ操作を3回行なう(3反復))
1.水酸化ナトリウム濃度の標定(ファクターの算出)
1-1)200ml容の三角フラスコに0.3-0.5gのフタル酸水素カリウムを秤取する。(0.3-0.5gの間の量であれば何gでも構わないが、正確に秤量して記録すること。)
1-2)脱塩水をメスシリンダーを用いて約50ml加えて溶かす。
1-3)pH指示薬(phenol
phtalein溶液、こちらで用意します)を2、3滴加える。
1-4)ビュレットを用いて0.1M水酸化ナトリウム溶液で滴定する。
1-5)滴定量とフタル酸水素カリウムの重量から、0.1M水酸化ナトリウム溶液のファクターを算出する。
2.硫酸濃度の測定
2-1)ホールピペットを用いて0.05M硫酸溶液を10mlを三角フラスコに移す。
2-2)pH指示薬(phenolphtalein溶液、こちらで用意します)を2、3滴加える。
2-3)ビュレットを用いて0.1M水酸化ナトリウム溶液で滴定する。
2-4)2-1)〜2-3)の作業を3回繰り返した後、次節の誤差解析を行い、十分な精度の滴定が行えたか確認する。次節の基準に合わない場合は、さらに2-1)〜2-3)の作業を3回繰り返す。
注意事項
1)
秤の使い方(薬包紙の使い方—秤への乗せ方、薬さじの使い方、試薬の使い方)実験を開始する前に電子天秤の使用方法、薬包紙の使い方などを熟読すること。薬包紙を電子天秤の秤の上に置いた後にゼロを取ること。試薬は、電子天秤のそばに持っていき、きれいな薬さじを用いて必要量と考えられる量よりも少ない分量をすくいとる。取り過ぎた試薬は試薬瓶に戻してはいけない。今回の実験では大量の水に溶解して廃棄する。試薬瓶は使用後かならず密封すること。
2)
メスシリンダーの使い方(特に濃硫酸などの取り扱いに注意を要する試薬を扱う場合)ガロン瓶(3リットル容の大きな試薬瓶、良く使用する)から直接メスシリンダーに試薬を移すことはしてはいけない。必ずビーカーに一度移した後にメスシリンダーに分注すること。
3)
計量容器の使い方(試薬の溶解の仕方、ビーカーから移すとき、メスアップのやりかたー机の上に置く方針で、器具の洗浄方法)試薬の溶解はビーカーを用いて行なうこと。最終的にメスアップするのに必要な容量よりも少ない容量で溶解すること。ビーカーからメスシリンダー、メスフラスコに移す時に中身を回収するのに必要な液量も考慮すること。ビーカーから計量容器に移す際にはガラス棒を伝わらせてゆっくりと行なうことが望ましい。メスアップする時には平らな机の上において自分の目の高さを液面に合わせて行なうこと。ただし、それが不可能な場合には手で持ち、目の高さに合わせること。また、溶液の入っている部分、また入る部分を手で持たないこと(温度が加わり容量が変化するため)。計量容器は洗浄に際してブラシを用いないこと(原則)。また、乾燥は自然乾燥で行なう。
4)
ファクター(factor, f.) 標準溶液で0.1M・HClと記したものは,その濃度は厳密に0.1Mである.しかし、自分で作成した溶液等の場合、実際の濃度は0.1Mとずれる場合が多い(たとえば0.1035M)。この溶液は0.1M・HCl(標準溶液)の1.035倍のHClを含むことを意味するから,この1.035を係数(ファクター)と考え
0.1M・HCl(f =1.035)と記す習慣が広く行われている.
参考:中和滴定と中和指示薬
中和滴定法は中和反応を利用する方法であり,酸-塩基の中和反応の終点をみるために普通は中和指示薬が使われる.指示薬はpHによって変色する色素で,例えばメチルレッドはpH4.2より酸性側では赤色,pH6.3よりアルカリ性側では黄色で,pH4.2〜6.3の間で赤色から黄色に変色する.これを変色域という.
塩酸のような強い酸を水酸化ナトリウムのような強い塩基で中和する場合の中和滴定曲線は図3.5に示したA〜Cのようになる.この場合は広いpH範囲にわたって中和滴定曲線が垂直になっているので中和指示薬としてメチルレッド(変色域:pH4.2〜6.3)を使っても,フェノールフタレイン(変色域:pH8.3〜10.0)を使ってもほとんど当量点の決定に大きな差を与えない.しかし酢酸のような弱い酸を水酸化ナトリウムのような強い塩基で中和すると,中和滴定曲線はB〜Cのように変化するから,フェノールフタレインの変色域は中和滴定曲線の垂直部に入るので当量点の決定に正しい結果を与えるが,メチルレッドでは変色域のpHが小さい方にあるため中和滴定の垂直部からずれて正しい結果が得られない.
したがって,弱酸を強塩基で,あるいは弱塩基を強酸で中和するような場合には適切な指示薬を選ばなければならない.主な中和指示薬と変色域を表1に示す.

表1 指示薬と変色域
|
指示薬
|
酸性側
|
アルカリ側
|
変色域(pH範囲)
|
|
チモールブルー
|
赤
|
黄
|
1.2 〜 2.8
|
|
メチルオレンジ
|
橙赤
|
黄
|
3.1 〜 4.4
|
|
ブロムフェノールブルー
|
黄
|
青
|
3.0 〜 4.6
|
|
メチルレッド
|
赤
|
黄
|
4.2 〜 6.3
|
|
ブロムフェノールレッド
|
黄
|
赤
|
4.8 〜 6.4
|
|
ブロムクレゾールパープル
|
黄
|
紫
|
5.2 〜 6.8
|
|
ブロムチモールブルー
|
黄
|
青
|
6.0 〜 7.6
|
|
フェノールレッド
|
黄
|
赤
|
6.8 〜 8.4
|
|
クレゾールレッド
|
黄
|
赤
|
7.2 〜 8.8
|
|
チモールブルー
|
黄
|
紫
|
8.0 〜 9.6
|
|
フェノールフタレイン
|
無色
|
赤
|
8.3 〜 10.0
|
|
チモールフタレイン
|
無色
|
青
|
9.2 〜 10.6
|
滴定の方法
1) ビュレットに滴定用溶液を入れ、廃液用ビーカーを下に置いておく。コックを開けて滴下し、コックから先端までの間にある気泡を抜く。
2) 内壁に残った滴定用溶液が落ちるまで30-60秒程度待ち、ビュレット内の滴定用溶液の容量を読み取る。
3) 試料溶液に指示薬を加える。
4) 片手で三角フラスコを持ち、もう片方の手でビュレットのコックを開き滴定用溶液を滴下する。滴下は慎重に行う。この時ビュレットを持っている手でコックをビュレット本体の方に引き付けながら開閉の操作を行なうように心掛けて下さい。(まずは脱塩水で練習することをおすすめします)滴下を勢いよく行うと、内壁に滴定用溶液を残し誤差の原因となる。
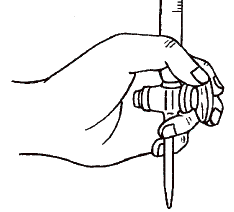
5) 滴下する度に三角フラスコを撹拌する。慣れれば撹拌しながら滴下することも出来るようになる。
6) 滴定を始めた時点では、滴定用溶液が試料溶液に落ちた瞬間に、落ちた場所に指示薬の発色が見られるが瞬時に色が消えてしまう。滴定終点に近付くと、発色する範囲と時間が拡大していく。

7) 滴定終点に近付いたら、一滴ずつ、もしくは一滴以下の量を少しずつ加える。一滴以下の量を加えるには、ビュレットのコックをわずかに開き、液滴が滴下しない程度に少し出し、これをガラス棒の先端に受け取り、三角フラスコの内壁に付けるか、試料溶液の水面にガラス棒の先端を少し浸けるかして、試料溶液に混ぜる。
8) 滴定終点の判断は初めての場合、難しい。フェノールフタレインを指示薬とした場合、滴定終点を過ぎると試料溶液がピンク色に染まる。淡くピンク色に染まる最低限度の滴下量が滴定終点である。それを超えてしまうと、その上さらに滴定用溶液を入れてもピンク色のままである。そこで初めての場合は、滴定用溶液を入れ過ぎてしまう失敗をおかしやすい。滴定終点に近付いたら、少量ずつ滴定用溶液を加え、撹拌しても淡いピンク色が残るようであれば、そこを滴定終点とする。初めのうちは、溶液の色の変化に注意し、怪しいと思ったらビュレットの目盛をこまめに記録しておくのがよい。
9) フェノールフタレインが発色するのはpH8.3〜pH10.0の範囲である。このアルカリ状態では大気中のCO2が溶け込み、滴定終点まで滴定しても数十秒程度で、CO2
+ OH- = HCO3-の反応が起き、pHが低下してピンク色の発色が消えてしまうことがある。撹拌しても数秒から十数秒間淡いピンク色が持続すれば滴定終点である。その後にピンク色が消えても気にする必要はない。
レポート
実験終了時に各班毎にレポートを提出してもらいます。
必須記入事項:各自の測定値、平均値、班の中での各自のデータのばらつき。
実験を行なって気付いた点、反省事項。
各担当教官の連絡先
土壌学分野
倉持寛太 706-2503 (N249室)
中原 治 706-2427 (N348室)土壌学分野責任者
(nakahara@chem.agr.hokudai.ac.jp)
作物栄養学分野
渡部敏裕 706-3845(N350室)
信濃卓郎 706-2498(N351室)作物栄養学分野責任者
(takuro@chem.agr.hokudai.ac.jp)
欠席、遅刻の場合はあらかじめ電話、あるいはメールにて連絡を入れること。
教官はなるべく実験室にいるようにするが、もし不在時に事故が発生し、緊急に連絡を取る必要が生じた場合は上記の電話、さらに不在の場合は下記の携帯電話に連絡を取ること。
中原
信濃
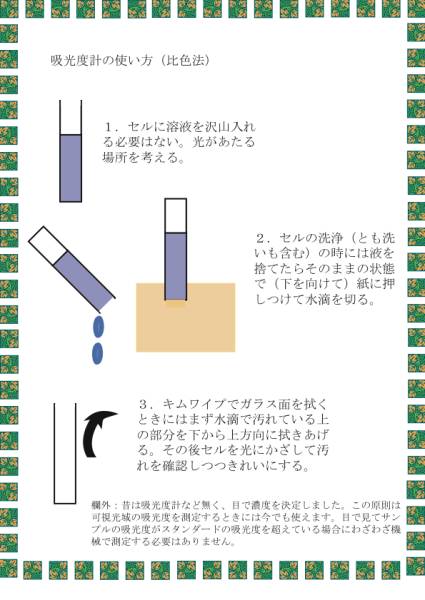
ここでは実験は行なわないが、吸光度計のセルの使い方を覚えておいてください。